Sinds de oudheid zijn wijnstokken geselecteerd op hun prestaties. Enkel de beste wijnstokken, met volle trossen, grote groeikracht, of verbeterde ziekteresistentie werden gebruikt om druiven te verbouwen. Deze menselijke selectie van ‘wilde’ druiven en natuurlijke kruisingen heeft gezorgd voor de klassieke wijndruiven zoals we die nu kennen. De laatste decennia zijn er echter verschillende genetische technieken ontwikkeld waarmee deze selectie versneld kan worden, of de wijnstok zelfs naar wens kan worden aangepast. Maar, wat doen deze technieken precies? Schuilen er risico’s aan het gebruik? En wat kunnen ze betekenen voor de wijnbouw?
Plantveredeling
Er zijn verschillende methoden om een wijnstok, of een plant in het algemeen, gunstigere eigenschappen mee te geven. De meest gebruikte en alom geaccepteerde vorm van menselijke sturing is het kruisen van twee planten. Door geslachtelijke vermeerdering – het bestuiven van de bloem met het stuifmeel van een andere plant – wordt het dna, en daarmee de eigenschappen van twee planten gecombineerd. Om te voorkomen dat al aanwezige gunstige eigenschappen in de wijndruif verloren gaan door de kruising worden ze teruggekruist met de originele plant. Na een langdurig proces van selectie (op de juiste eigenschappen), terugkruisen, selectie, terugkruising, etc. ontstaat uiteindelijk een plant die erg veel lijkt op de originele wijndruif, maar wel met de extra gewenste eigenschap (Figuur 1A).
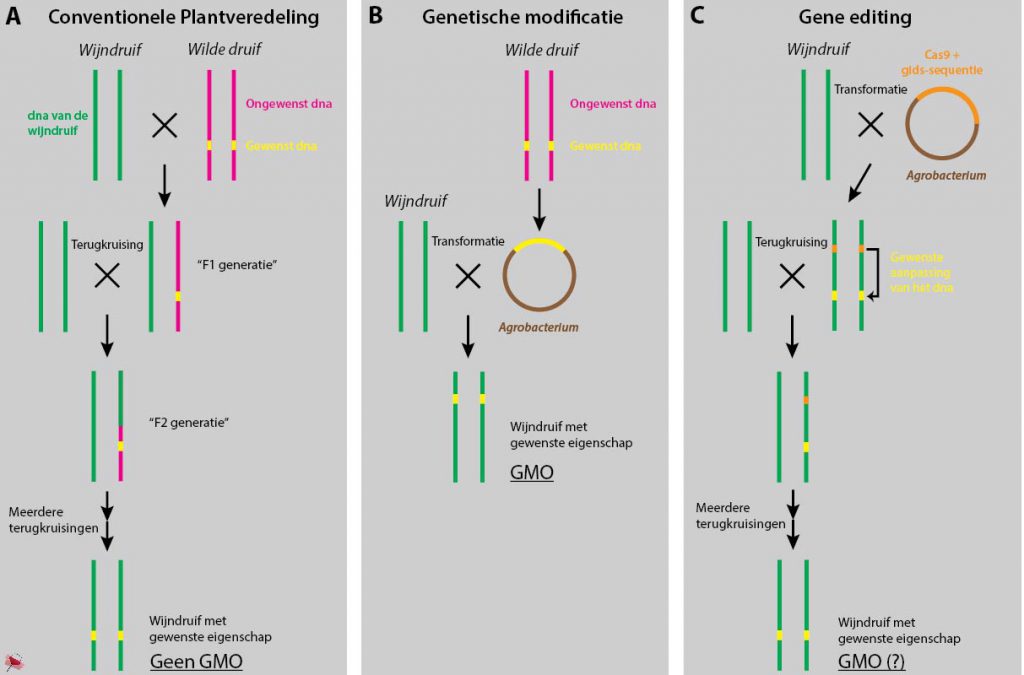
Figuur 1. Overzicht van de methoden voor plantveredeling en modificatie. Conventionele plantveredeling (A) is het gebaseerd op het geslachtelijk vermeerderen van verschillende planten. Er onstaat een nieuwe plant die niet genetisch gemodificeerd is. Genetische modificatie (B) knipt-en-plakt dna vanuit een ander organisme met behulp van (bijvoorbeeld) Agrobacterium. De nieuwe wijndruif die ontstaat is een genetisch gemodificeerd organisme (GMO). Bij gene editing (C) wordt de CRISPR/Cas9 methode toegepast om het eigen dna van de plant aan te passen. Door terugkruising is het vervolgens mogelijk om het plant-vreemde dna weer te verwijderen.
Genetische modificatie
In sommige gevallen is het bekend welk stuk dna verantwoordelijk is voor een gewenste eigenschap van de plant. Bij genetische modificatie wordt dit stuk dna, en daarmee de gewenste eigenschap, simpelweg ‘geknipt en geplakt’ vanuit de ene plant naar het dna van een andere plant. Het lange proces van veredeling en selectie wordt hiermee omzeild. De nieuwe plant die op deze manier ontstaat is een genetisch gemodificeerd organisme, een GMO. Een GMO kan gemaakt worden uit twee organismen die ook in de natuur zich met elkaar kunnen voorplanten, bijvoorbeeld twee verschillende wijndruiven. Maar, het is ook mogelijk om een GMO te maken van twee organismen die zich in de natuur niet gezamenlijk kunnen voortplanten, bijvoorbeeld een kwal en een muis, of een bacterie en een wijndruif. In alle gevallen zal er ‘vreemd’ dna ingebouwd worden in het dna van een ander organisme. De grootste bariere in dit proces is samenbrengen van het nieuwe dna met het dna in de cel.
Het inbrengen van het gewenste dna in een nieuwe cel – de zogenaamde transformatie – kan plaatsvinden met tal van technieken, van een elektrisch veld dat de celwand doordringbaar maakt, een minuscule injectie van het dna in de cel, tot aan dna dat gebonden aan gouddeeltjes met een ‘gene gun’ de cellen in wordt geschoten. Bij planten wordt voor de genetische modificatie echter vaak gebruik gemaakt van de Agrobacterium bacterie1, 2. Deze bacterie heeft als unieke eigenschap dat hij een deel van zijn dna overbrengt en inbouwt in het dna van de plantencel. Normaalgesproken zorgt het stuk dna dat hij inbouwt voor kroongalziekte, waarbij gezwellen ontstaan op de wortels van de plant. Door dit stuk dna te vervangen door het gewenste dna bouwt de bacterie niet deze ziekte in, maar een gewenste eigenschap. De bacterie is hierbij echter niet erg kieskeurig en kan zijn dna op een vrijwel willekeurige plaats inbouwen in het dna van de plant3. De plant die gekweekt wordt vanuit deze met Agrobacterium behandelde plantencel bevat het nieuwe gen in het dna van al zijn cellen. Een GMO is geboren (FIGUUR 1B).
Gene editing
Sinds 2012 is de genetica (en de wereld daarbuiten) in de ban van de CRISPR/Cas9 techniek. Deze techniek is gebaseerd op het anti-virus mechanisme van bacteriën en kan gebruikt worden om het dna van een organisme direct aan te passen. De heilige graal voor de genetica! Geen knip-en-plakwerk meer vanuit een ander dier of plant. Of toch wel?
CRISPR/Cas9, een bacterieel afweermechanisme
Allereerst de werking van deze CRISPR/Cas9 techniek. CRISPR is een biologische bibliotheek van allerlei stukjes dna. De bacterie heeft al deze stukjes dna verzameld wanneer hij werd aangevallen door een virus. Bij een nieuwe virusaanval speurt de bacterie met behulp van het Cas9-eiwit zijn CRISPR bibliotheek af of hij een stuk dna heeft waarmee hij het virus kan herkennen. Cas9 kopieert het juiste stuk dna uit de bibliotheek en kan vervolgens het binnengedrongen virus herkennen en doorknippen. Het stuk dna uit de CRISPR bibliotheek dient dus als een ‘gids’ voor het Cas9 eiwit (FIGUUR 2A).
Onderzoekers hebben gebaseerd op dit afweermechanisme een slimmigheidje bedacht. Ze gebruiken dit hele mechanisme waarmee de bacterie het virus-dna herkent, maar passen de ‘gids-sequenties’ aan. Hierdoor kunnen ze precies sturen welk stuk planten-dna door Cas9 wordt doorgeknipt4. De (planten)cel zal vervolgens automatisch proberen om het doorgeknipte dna weer aan elkaar te plakken. Deze reparatie van het dna zorgt voor een klein ‘litteken’ op het dna, een minuscule mutatie. Deze mutatie is echter precies genoeg om de werking van een gen te veranderen of zelfs helemaal te stoppen. Er ontstaat zodoende een plant met een andere (gunstigere) eigenschap.
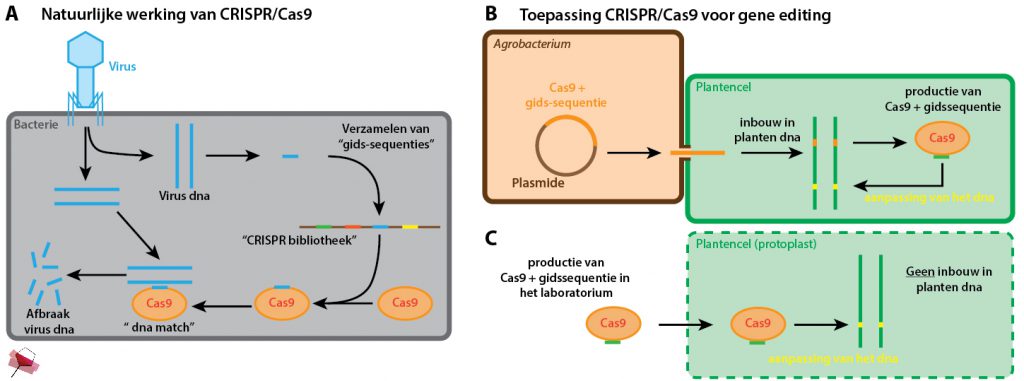
Figuur 2. De werking van CRISPR/Cas9. CRISPR en Cas9 zijn onderdeel van het natuurlijke virusafweerstysteem van bacteriën. CRISPR slaat stukken dna van binnengedrongen virussen op in een grote ‘bibliotheek’. Cas9 leest deze stukken dna af en gebruikt ze als ‘gidssequentie’ om bij een tweede aanval het virus te herkennen en af te breken (A). Agrobacterium brengt een plasmide (circulair dna dat niet behoort tot zijn chromosomale dna) met daarin dna van Cas9 en een gidssequentie ingebouwd in de plantencel in. Het ingebrachte dna wordt ingebouwd in het dna van de plant en gaat Cas9 en de gidssequentie produceren die vervolgens het planten-dna aanpassen (B). Inbreng van het Cas9 eiwit en de gidssequentie in een protoplast, een plantencel zonder celwand. Het dna van de plantencel wordt aangepast, maar er wordt geen vreemd dna ingebouwd (C).
Bacterieel DNA, dus een GMO
Maar zul je nu denken, hoe zit dat met dat knip-en-plakwerk? Hier komt toch nog steeds dna van de bacterie aan te pas? Precies. Sterker nog, de Agrobacterium wordt net als bij genetische modificatie ook hier gebruikt om het dna dat Cas9 en de aangepaste gidsequentie produceert in te brengen in de plantencel en vervolgens in te bouwen in het dna van de plant5 (FIGUUR 2B). De plantencel gaat hierdoor Cas9 en de gidssequentie produceren. Vervolgens herkent Cas9 met behulp van de gidssequentie het juiste stuk dna van de plantencel en knipt dit door waardoor een aanpassing van het dna ontstaat. Het bacterie-dna dat codeert voor Cas9 bevindt zich echter nog steeds in het dna van de plant, welke daarom per definitie een GMO is.
Toch geen GMO?
Maar een “GMO”, dat staat niet goed op de etiketten. Gelukkig zijn er daarom een aantal methoden bedacht om te voorkomen dat er zich ‘vreemd’ dna van de Agrobacterium bevindt in de plantencel. Een van deze methodes is gebaseerd op het aloude terugkruisen zoals dat ook bij de conventionele plantveredeling gebeurt. Het ingebouwde bacterie-dna wordt verwijderd door terug te kruisen met de originele plant. Van de nieuwe generatie(s) worden enkel de planten met het aangepaste dna, maar zonder het bacteriële Cas9-dna geselecteerd6 (zie ook FIGUUR 1C). Dit kan echter erg lang duren zeker wanneer het gaat om meerjarige planten waarbij geslachtelijk vermeerdering pas na een paar jaar kan plaatsvinden. Recent is er echter ook een manier gevonden om het Cas9-dna en de gidssequentie met Agrobacterium in de plantencel in te brengen zonder dat het ingebouwd wordt in het dna van de plant. Het planten-dna wordt dus wel aangepast door Cas9, maar terugkruisen is niet meer nodig. Deze techniek is alleen nog niet getest bij druiven7, 8.
Een andere methode is het kant-en-klaar inbrengen van het Cas9-eiwit en de gidssequentie in de plantencel (FIGUUR 2C)5, 9. Er wordt dus helemaal geen vreemd dna ingebouwd in het dna van de plant. Het lastige aan deze techniek is echter dat er plantencellen zonder celwand voor nodig zijn, zogenaamde protoplasten. Doordat deze cellen geen celwand hebben is het mogelijk om Cas9 en de gidssequentie toch de cel in te krijgen (en is Agrobacterium niet nodig). Het is echter vaak lastig om de protoplasten te verkrijgen, en ook om er weer een volledige plant uit te kweken. Wanneer dit toch lukt, dan zal het ingebrachte Cas9 niet doorgegeven worden bij het delen van de cellen. Enkel het aangepaste dna wordt gekopieerd en doorgegeven, en Cas9 en de gidssequentie zullen worden afgebroken.
Door deze methoden hebben de planten wel door Cas9 aangepast dna, maar bevatten ze geen spoor (meer) van het bacteriële CRISPR/Cas9-dna.

Hoe worden deze technieken gebruikt voor de wijnbouw?
Vooralsnog kan deze vraag vrij kort beantwoord worden. Alle klassieke en nieuwe wijnstokken die gebruikt worden voor de productie van wijn zijn ontstaan uit conventionele veredelingstechnieken. Druivenrassen zoals Johanniter, Müller-thurgau, Pinotage, Solaris, en nog vele anderen zijn op deze manier doormiddel van een langdurig selectie- en kruisingsproces door de mens gemaakt. Toch zijn er voor wetenschappelijke doeleinden wel wijnstokken zoals de Cabernet Sauvignon, Shiraz, Dornfelder, Riesling en Chardonnay genetisch gemodificeerd met behulp van Agrobacterium10-12. Deze druiven zijn echter niet in gebruik (en niet toegestaan) voor de productie van wijn.
Genetisch gemodificeerde gisten
Genetische modificatie is ook toegepast op gisten, om ze bijvoorbeeld ook de malolactische gisting te laten verzorgen. Zo is de ML01-gist dusdanig genetisch aangepast met een gen van de Oenococcus oeni bacterie waardoor het ook appelzuur naar melkzuur kan omzetten. Deze gist is verboden in Europa, maar is in Canada en de Verenigde staten toegestaan voor de productie van wijn13, 14. Er is behoorlijk wat controverse omtrent ML01, zeker ook omdat Duits onderzoek heeft laten zien dat genetisch gemodificeerde gisten (net als andere kweekgisten) onderdeel worden van de gistcultuur in de wijnkelder én in de wijngaard15. Gisten zijn daarom niet simpelweg een hulpstof bij de productie van wijn, maar hebben wel degelijk een ecologisch effect. Daarnaast zijn ze in Europa ook niet gekwalificeerd als hulpstof, omdat ze wel degelijk ook (zij het in zeer geringe mate) aanwezig kunnen zijn in de uiteindelijke wijn, ook wanneer deze gefilterd is16.
Lees nu ook: Snellere gistrijping door sonificatie
Toepassing van CRISPR/Cas9 in de wijnbouw
De CRISPR/Cas9 methode wordt inmiddels ook al getest voor toepassingen in de wijnbouw. Zo is aangetoond dat de CRISPR/Cas9 methode werkt bij de Chardonnay druif17, en zijn Thompson Seedless tafeldruiven resistenter gemaakt tegen Botrytis cinerea18. Ook commerciële wijngisten zijn al aangepast doormiddel van de CRISPR/Cas9 techniek. Er zijn namelijk twee Saccharomyces cerevisiae gisten aangepast zodat ze minder urea produceren19. Door de verminderde hoeveelheid urea wordt voorkomen dat tijdens de fermentatie de kankerverwekkende stof ethylcarbamaat gevormd kan worden waarvoor urea een bouwstof is.
Buiten directe aanpassingen van de wijnstokken of de wijngisten wordt ook de inzet van de CRISPR/Cas9 methode ter bestrijding van ziektes en plagen onderzocht. Zo wordt bijvoorbeeld de effectiviteit van het uitzetten van steriele Drosophila mannetjes in de wijngaard bekeken. Deze fruitvliegen zijn doormiddel van de CRISPR/Cas9 methode onvruchtbaar gemaakt, waardoor de voortplanting van de gehele populatie vermindert en een plaag voorkomen kan worden20. Een bijkomend voordeel is dat deze genetisch aangepaste vlieg zich niet verder kan verspreiden door deze onvruchtbaarheid. Twee vliegen in één klap dus.
Lees nu ook: De natuurlijke bestrijding van Drosophila Suzukii
Naast bovenstaande toepassingen zijn er nog tal van mogelijkheden te bedenken waarop de CRISPR/Cas9 techniek kan bijdragen aan een betere, smaakvollere of gezondere wijn door de verbetering van wijnstokken, wijngisten of doormiddel van de bestrijding van ziektes en plagen in de wijngaard. Al deze aanpassingen zijn echter erg mooi in een laboratorium, maar moeten dan ook wel goedgekeurd worden voor (grootschalig) gebruik in de wijnbouw.
De ethische discussie
Over het algemeen is er veel weerstand tegen GMO’s, want deze zijn “artificieel”, “onnatuurlijk” en hun ecologische effecten op langere termijn zijn onduidelijk. Maar wat nu wanneer een door de mens genetische aangepaste plant exact hetzelfde kan zijn als een natuurlijk voorkomende variant? Kleine mutaties van het dna zoals veroorzaakt door Cas9 ontstaan van nature namelijk ook vanzelf in het dna van de plant, bijvoorbeeld onder invloed van UV-straling of een andere omgevingsinvloed. De planten met deze mutaties hebben dan net iets andere eigenschappen.
In het geval van wijndruiven wil men dan graag verder gaan kweken met de planten die deze verbeterde eigenschappen hebben. Gebaseerd op dit principe zijn er in de Bourgogne vele honderden klonen gemaakt van de Pinot noir druif. Elke kloon heeft een minuscule variatie in zijn dna die zorgt voor een net iets andere eigenschap, een iets betere resistentie tegen meeldauw, openere trossen, meer groeikracht, en ga zo maar door. Omdat deze variaties dus ook in de natuur kunnen ontstaan is het zonder voorkennis onmogelijk om te bepalen of een bepaalde variatie natuurlijk is ontstaan, of artificieel door de mens met de CRISPR/Cas9 methode. Het is dan ook de vraag of deze aangepaste plant wel een GMO genoemd moet worden. Bij het kruisen van twee wijndruiven stuurt de mens tenslotte ook de hercombinatie van het dna, alleen minder precies.

Amerika vs. Europa
Het Amerikaanse ministerie van landbouw heeft vorig jaar stelling genomen in deze discussie door aan te geven dat ze enkel het eindproduct beoordelen. Als wijzigingen van het plant-dna ook op natuurlijke wijze of via conventionele plantveredelingstechnieken kunnen plaatsvinden, en als de uiteindelijke plant niet over vreemd (niet-eigen) dna beschikt, dan is het geen GMO. Dit is ongeacht of er technieken voor genetische modificatie aan te pas zijn gekomen om de plant te creëeren. In de verenigde staten is dan ook al een met CRISPR aangepaste champignon als niet-GMO bestempeld. Door de aanpassing kleurt de champignon veel minder snel bruin waardoor zijn houdbaarheid wordt verlengd21.
Het Europese hof van justitie heeft afgelopen jaar echter exact het tegenovergestelde bepaald. Er is namelijk besloten dat de CRISPR/Cas9 techniek valt onder de bestaande GMO regeling (van oudere genetische modificatie technieken)22. In Europa wordt elke plant die bewerkt is met genetische modificatie technieken daarmee geschaard onder de noemer GMO. Ook als er geen enkel spoor van deze methoden aanwezig zijn in het uiteindelijke dna van de plant.
Mutagene techniek & handhaving
Voorstanders van de CRISPR/Cas9 techniek zijn het niet eens met het besluit van het Europese hof van justitie en vinden dat het een mutagene techniek is. CRISPR/Cas9 kan namelijk mutaties aanbrengen in het dna van een organisme zonder de introductie van vreemd dna. CRISPR/Cas9 zou dus net als andere mutagene technieken – zoals blootstelling aan straling – niet onder de GMO regeling moeten vallen. Tegenstanders vinden echter dat dit wel moet, omdat het om gerichte mens-gestuurde mutaties gaat23. Maar maakt dit uit als er spontaan precies een zelfde natuurlijke variatie in de plant kan ontstaan?
Hoe dan ook, er is op dit moment wereldwijd nog geen consensus over hoe er met de CRISPR/Cas9 techniek moet worden omgegaan. Dit kan in de toekomst problemen op gaan leveren met de import en export van producten die met behulp van de CRISPR/Cas9 techniek tot stand zijn gekomen. Het is namelijk voor overheden, wijnboeren én consumenten onmogelijk om een natuurlijk gekruiste wijnstok te onderscheiden van een CRISPR/Cas9-wijnstok. Handhaving van een CRISPR/Cas9-verbod gaat daarom erg lastig worden.
REFERENTIES
1. Zambryski P, Joos H, Genetello C, Leemans J, Montagu MV, Schell J. Ti plasmid vector for the introduction of DNA into plant cells without alteration of their normal regeneration capacity. The EMBO journal. 1983;2(12):2143-50.
2. Nester E. Agrobacterium: The Natural Genetic Engineer (100 Years Later) The American Phytopathological Society APSnet Features. 2011.
3. Gelvin SB. Agrobacterium-mediated plant transformation: the biology behind the “gene-jockeying” tool. Microbiology and molecular biology reviews : MMBR. 2003;67(1):16-37, table of contents.
4. Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science (New York, NY). 2012;337(6096):816-21.
5. Osakabe Y, Liang Z, Ren C, Nishitani C, Osakabe K, Wada M, et al. CRISPR-Cas9-mediated genome editing in apple and grapevine. Nature protocols. 2018;13(12):2844-63.
6. Char SN, Neelakandan AK, Nahampun H, Frame B, Main M, Spalding MH, et al. An Agrobacterium-delivered CRISPR/Cas9 system for high-frequency targeted mutagenesis in maize. Plant biotechnology journal. 2017;15(2):257-68.
7. Chen L, Li W, Katin-Grazzini L, Ding J, Gu X, Li Y, et al. A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants. Horticulture research. 2018;5:13.
8. Veillet F, Perrot L, Chauvin L, Kermarrec MP, Guyon-Debast A, Chauvin JE, et al. Transgene-Free Genome Editing in Tomato and Potato Plants Using Agrobacterium-Mediated Delivery of a CRISPR/Cas9 Cytidine Base Editor. International journal of molecular sciences. 2019;20(2).
9. Malnoy M, Viola R, Jung MH, Koo OJ, Kim S, Kim JS, et al. DNA-Free Genetically Edited Grapevine and Apple Protoplast Using CRISPR/Cas9 Ribonucleoproteins. Frontiers in plant science. 2016;7:1904.
10. Iocco P, Franks T, Thomas MR. Genetic transformation of major wine grape cultivars of Vitis vinifera L. Transgenic research. 2001;10(2):105-12.
11. Torregrosa L, Locco P, Thomas MR. Influence of Agrobacterium strain, culture medium, and cultivar on the transformation efficiency of Vitis vinifera L. American Journal of Enology and Viticulture. 2002;53:183-90.
12. Bornhoff B-A, Harst M, Zyprian E, Töpfer R, Lannini C. Transformation studies on Vitis vinifera L., via Agrobacterium tumefaciens. Acta Horticulturae. 2000;528:359-60.
13. Food and Drug Administration (FDA). Gras Notice 120. 2003.
14. Government of Canada. Risk assessment summary for EAU-224: Saccharomyces cerevisiae strain ML01. Van Vuuren and Associates; 2006. p. 1-6.
15. Grossmann M, Kießling F, Singer J, Shoeman H, Schröder M-B, Von Wallbrunn C. Genetically modified wine yeasts and risk assessment studies covering different steps within the wine making process. Annals of Microbiology. 2011;61(1):103-15.
16. Nisiotou AA, Gibson GR. Isolation of culturable yeasts from market wines and evaluation of the 5.8S-ITS rDNA sequence analysis for identification purposes. Letters in applied microbiology. 2005;41(6):454-63.
17. Ren C, Liu X, Zhang Z, Wang Y, Duan W, Li S, et al. CRISPR/Cas9-mediated efficient targeted mutagenesis in Chardonnay (Vitis vinifera L.). Scientific reports. 2016;6:32289.
18. Wang X, Tu M, Wang D, Liu J, Li Y, Li Z, et al. CRISPR/Cas9-mediated efficient targeted mutagenesis in grape in the first generation. Plant biotechnology journal. 2018;16(4):844-55.
19. Vigentini I, Gebbia M, Belotti A, Foschino R, Roth FP. CRISPR/Cas9 System as a Valuable Genome Editing Tool for Wine Yeasts with Application to Decrease Urea Production. Frontiers in microbiology. 2017;8:2194.
20. Kandul NP, Liu J, Sanchez CH, Wu SL, Marshall JM, Akbari OS. Transforming insect population control with precision guided sterile males with demonstration in flies. Nature communications. 2019;10(1):84.
21. A CRISPR definition of genetic modification. Nature plants. 2018;4(5):233.
22. Court of Justice of the European Union. Judgment in Case C-528/16 2018 [Available from: https://curia.europa.eu/jcms/upload/docs/application/pdf/2018-07/cp180111en.pdf.] Geraadpleegd op 15 februari 2019.
23. Callaway E. CRISPR plants now subject to tough GM laws in European Union. Nature. 2018;560(7716):16.
OPMERKING: Dit artikel is eerder gepubliceerd in Wijn en Wijngaard no. 1, 2019. (Herprint met toestemming)