Verandering van klimaat, consumentenvoorkeur of zelfs accijnsbelastingen zijn allemaal redenen om wijn met minder alcohol te produceren. Het is echter moeilijker dan het lijkt om laag-alcoholische wijn te produceren zonder restsuiker en mét een aromatisch profiel dat voldoet aan de eisen van een kwaliteitswijn. Het gebruik van gisten die minder alcohol produceren lijkt voor de hand te liggen, maar zijn ze wel de oplossing?
Het beheersen van de hoeveelheid alcohol in de wijn begint al in de wijngaard. De hoeveelheid suiker in de druiven kan namelijk verminderd worden door het bladoppervlak per tros te verminderen, het rendement te verhogen, of aanpassingen te doen in het type onderstok, het druivenras, de ligging van de wijngaard of de waterhuishouding1. Bevat de most na deze aanpassingen nog steeds te veel suiker dan zijn er een aantal (moderne) keldertechnieken die gebruikt kunnen worden. De simpelste manier is om wijn te blenden met wijn met een lager alcoholpercentage, of met water (!). Daarnaast kan het glucosegehalte in de most verlaagd worden door filtratie, of door toevoeging van het enzyme glucose oxidase. Deze laatste zet glucose om naar gluconzuur zodat het niet meer omgezet kan worden in alcohol maar heeft hier wel oxidatieve condities voor nodig2. Als laatste kan ook nog omgekeerde osmose toegepast worden op de uiteindelijke wijn om het (gedeeltelijk) te dealcoholiseren. Deze keldertechnieken zijn echter niet altijd toegestaan, en kunnen daarnaast ook een grote invloed hebben op de sensorische eigenschappen van de wijn. Onderzoek naar de productie van laag-alcoholische wijn richt zich dan ook vaak op de bron van de alcoholproductie, de gisten.
De komende paragrafen geven een overzicht van hoe de moleculaire omzetting van suiker naar alcohol plaatsvindt in de gisten, en welke experimentele wegen er bewandeld worden om met behulp van gisten de hoeveelheid alcohol in de wijn te beperken.
De omzetting van glucose door gisten
Het koolstofmetabolisme
In de most nemen gisten suiker (glucose) op dat vervolgens in de gistcel door verschillende metabolische stappen wordt omgezet naar alcohol (zie Figuur 1). Glucose en alcohol (ethanol) zijn koolstofverbindingen, ze bestaan uit een koolstofstructuur, waaraan zuurstof- en waterstofatomen gebonden zijn. In de gistcel wordt glucose allereerst omgezet naar pyruvaat. Dit proces wordt de ‘glycolyse’ genoemd. Pyruvaat dient vervolgens als grondstof voor de citroenzuurcyclus in de mitochondrieën – de energiecentrales van de cel. De afbraak en omzetting van koolstofverbindingen zoals glucose en pyruvaat in de cel wordt het koolstofmetabolisme genoemd. De glycolyse en de citroenzuurcyclus vormen samen een groot deel van het koolstofmetabolisme van de gistcel en produceren de energierijke verbindingen ATP en NADH. Deze verbindingen zijn de “brandstof” van de cel en zijn noodzakelijk voor het verlopen van veel metabole processen waardoor de gistcel kan groeien en zich kan vermenigvuldingen. Wanneer er geen aanvoer van glucose meer is – bijvoorbeeld omdat alle glucose in de most is opgebruikt – dan vallen de processen in de gistcel stil en zal deze uiteindelijk dood gaan.
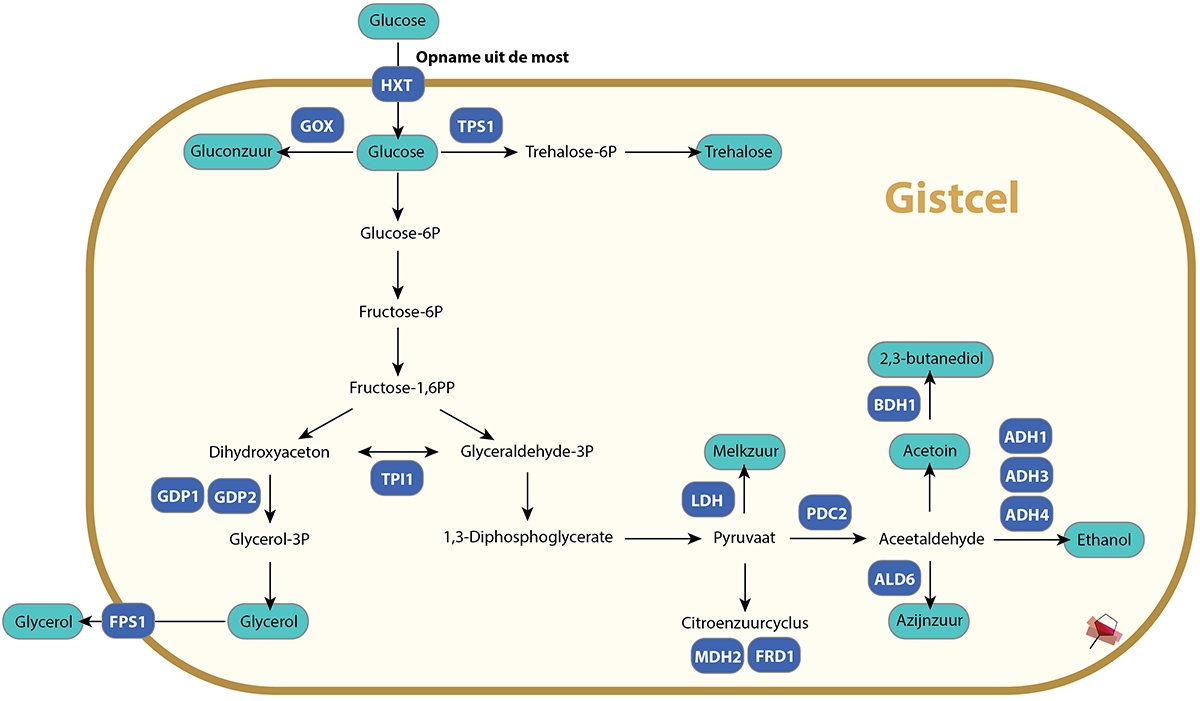
FIGUUR 1. Het koolstofmetabolisme in de gistcel. Glucose wordt via de glycolyse omgezet in pyruvaat. Pyruvaat dient vervolgens als grondstof voor de citroenzuurcyclus waarin de energierijke verbindingen ATP en NADH geproduceerd worden, of kan worden omgezet naar melkzuur of aceetaldehyde. De belangrijkste (bij)producten van het koolstofmetabolisme zijn weergegeven in turquoise. Eiwitten in de cel zorgen er voor dat de omzetting van het ene naar het andere reactieproduct kan plaatsvinden. In het blauw zijn de eiwitten weergegeven die in verschillende onderzoeken genetisch zijn gemodificeerd om de gist minder alcohol te laten produceren. (Figuur op basis van referenties 4-6).
De bijproducten
Het koolstofmetabolisme produceert verschillende bijproducten die ontstaan als ‘afvalproducten’ bij de omzetting van glucose (en pyruvaat) naar energie (zie Figuur 1). Wetenschappers hebben zich lang afgevraagd waarom gisten deze producten zoals ethanol, azijnzuur, en glycerol produceren en dit niet verder afbreken naar het minder energetische CO2. Er is recent een theorie ontwikkeld door Groningse wetenschappers die stelt dat het waarschijnlijk is om het metabolisme van de cel te ‘ontlasten’. Bij een overmaat aan glucose gaat het koolstofmetabolisme van de gistcel namelijk als een razende aan de slag om dit om te zetten in energie. Er is echter een maximum aan wat de cel aan kan. Wanneer dit maximum bereikt is, dan wordt glucose – om overbelasting van de cel te voorkomen – snel omgezet naar andere bijproducten, ook al hebben deze producten nog energetische waarde3.
Saccharomyces cervisiae gisten zijn van nature goed in de omzetting van glucose met alcohol als hoofdzakelijk ‘afvalproduct’ van het koolstofmetabolisme. Ze zijn daarom uitermate geschikt voor een zuivere alcoholische fermentatie, en produceren weinig bijproducten zoals glycerol, melkzuur, azijnzuur, acetoin en 2,3-butanediol die een nadelig sensorisch effect op de wijn kunnen hebben (zie Tabel 1). Voor de productie van laag-alcoholische wijn zijn echter gisten nodig die minder efficiënt alcohol produceren, maar wel al het glucose in de most opgebruiken (anders kunnen er alleen zoete wijnen gemaakt worden). Gisten met deze aanpassing van het koolstofmetabolisme moeten echter nog steeds voldoende energierijke verbindingen produceren voor het in stand houden van de gistcel, en de alternatieve eindproducten moeten de kwaliteit van de wijn niet negatief beïnvloeden5,9. Vooral dit laatste is een enorme uitdaging.
| Tabel 1. | Veelvoorkomende bijproducten van de alcoholische fermentatie en hun invloed op de wijn4,5,7,8 |
| Bijproduct | Sensorisch effect op de wijn |
| 2,3-butanediol | Vrijwel geen sensorisch effect, bij hogere concentraties visceus en een licht bittere smaak. |
| Aceetaldehyde | Bij lage concentraties fruitige aroma’s, bij hogere concentraties gekneusde appel, geoxideerde, noot-achtige en sherry-achtige aroma’s. |
| Acetoin | Boter-achtige aroma’s |
| Azijnzuur | Een zwak zuur met azijn aroma’s |
| Glycerol | Licht zoetig en geeft een ronder mondgevoel |
| Melkzuur | Een mild zuur met melkaroma’s |
Het vinden van de juiste gist voor laag-alcoholische wijn
Genetische modificatie van gisten
Door (enzymatische) stappen in het koolstofmetabolisme sneller of juist langzamer te laten werken kan de productie van de verschillende bijproducten worden veranderd. Veel metabole stappen worden gereguleerd door eiwitten. Door de hoeveelheid van deze eiwitten te verhogen of juist te verlagen kan de snelheid van de reactiestappen aangepast worden. Bij een hogere productie van de eiwitten zal de reactiestap sneller verlopen, en bij een verminderde productie juist lager. Met behulp van genetische technieken kan het stuk dna – het gen – dat codeert voor een eiwit worden aangepast, waardoor er meer of minder van dit eiwit geproduceerd wordt in de gistcel. Bij een ‘overexpressie’ van het gen wordt het eiwit meer geproduceerd, en bij een ‘deletie’ wordt het eiwit minder geproduceerd. Ook kan het gen worden aangepast waardoor het eiwit een verbeterde, of juist verminderde functie krijgt. In Tabel 2 is een overzicht gegeven van de eiwitten waarvan de productie of functie in de gistcel is aangepast met behulp van genetische modificatie. Deze eiwitten zijn ook weergegeven in Figuur 1 bij de reactiestap die ze reguleren in het koolstofmetabolisme. Het doel bij al deze onderzoeken was het afbuigen van het koolstofmetabolisme, weg van de productie van alcohol, en richting de productie van andere bijproducten. Veel van deze genetische modificaties waren niet succesvol voor de productie van gisten voor laag-alcoholische wijn. Dit komt omdat ze bijvoorbeeld de groei van de gistcellen remden, een te klein effect op het alcoholpercentage hadden, of te veel ongewenste bijproducten zoals aceetaldehyde, azijnzuur of acetoin produceerden.
| Tabel 2. | Genetische aanpassingen in het koolstofmetabolisme van gisten om direct of indirect minder alcohol te produceren5,6. De eiwitten waarvan door genetische modificatie de productie is geblokkeerd (deletie) of verhoogd (overexpressie) zijn ook weergegeven in Figuur 1. De glucosetransporter HXT is aangepast zodater er minder (snel) glucose opgenomen wordt, en het eiwit FPS1 is aangepast zodat het glycerol sneller de gistcel uit transporteert. |
| Beoogd effect | Genetische aanpassing |
| Beperking van de glucose opname | HXT aanpassing |
| Afbraak van glucose | TPS1 overexpressie; GOX1 overexpressie |
| Verhogen van de glycerol productie | GPD1 of GPD2 overexpressie; TPI1 deletie; FPS1 aanpassing |
| Verhogen van melkzuur productie | LDH overexpressie |
| Verminderen van de ethanol productie | PDC2 deletie; ADH1, ADH3, of ADH4 deletie |
| Verminderen azijnzuur productie | ALD6 deletie |
| Verhogen van 2,3-butanediol productie | BDH1 overexpressie |
| Versnellen van de citroenzuurcyclus | MDH2 overexpressie; FRD1 overexpressie |
Bijna succesvol
De omschakeling van het koolstofmetabolisme richting de productie van glycerol lijkt de meest beloftevolle methode om de gisten aan te passen. Afhankelijk van de concentratie zijn de effecten van glycerol op de wijn acceptabel en soms zelfs gunstig. De verhoogde productie van de eiwitten GPD1 en GPD2 zorgen voor een verhoogde productie van glycerol (tot 548% hoger) en voor een maximale verlaging van het alcoholpercentage met 3.6% REF5. De wijn bevat naast verhoogde glycerol levels echter ook hoge concentraties aceetaldehyde en acetoin die de wijnsmaak negatief beïnvloedden10. Om dit tegen te gaan is een nieuwe gist gemaakt waarin ook het enzyme ALD6 is uitgeschakeld om de metabolische route richting aceetaldehyde en azijnzuur te verminderen. Deze aanpassing zorgt voor een verlaging van de productie van azijnzuur, maar nog steeds is de hoeveelheid aceetaldehyde in de wijn te hoog. De wijnen hebben hierdoor ongewenste aroma’s van “gekneusde appels” 10-12. Om ook hier weer voor te compenseren is het gen BDH1 tot overexpressie gebracht. Op deze manier wordt het teveel aan aceetaldehyde omgezet naar acetoin en vervolgens naar het neutrale 2,3-butanediol. Deze gisten, met aangepast GPD1, ALD6 en BDH1 produceren acceptable hoeveelheden aceetaldehyde, azijnzuur, acetoin en 2,3-butanediol, maar helaas ook minder glycerol en meer alcohol dan voor de BDH1-aanpassing. Waarschijnlijk komt dit doordat deze aanpassingen een te groot effect hebben op de energiebalans van de cel. Hierdoor is er te weinig NADH beschikbaar is voor alle reactiestappen in het koolstofmetabolisme die afhankelijk zijn van NADH10,13.
Lees nu meer over de CRISPR technologie in de wijngaard
De genetische modificatie van wijngisten heeft al met al veel inzicht gebracht in ontwikkeling van gisten voor laag-alcoholische wijn. Helaas lopen alle huidige onderzoeken dood doordat de gemodificeerde gisten die een lage alcoholproductie hebben ook te veel ongewenste bijproducten produceren. Daarnaast is het gebruik van genetisch gemodificatie niet geaccepteerd voor commerciële wijnproductie. Het is mogelijk dat de CRISPR technologie hier nog uitkomst kan bieden en het mogelijk maakt om aangepaste gisten te gebruiken. Maar nog steeds moet ook dan een laag-alcoholproducerende gist ontwikkeld worden die de wijn niet sensorisch benadeelt. De opgedane kennis kan echter wel gebruikt worden voor de ontwikkeling van gisten zonder het gebruik van genetische modificatie.
Evolutie in het laboratorium
Gisten zijn snel delende organismen en kunnen zich daardoor snel evolutionair aanpassen aan nieuwe omstandigheden. Van dit principe kan gebruik gemaakt worden om nieuwe Saccharomyces gisten te kweken die bijvoorbeeld meer glycerol produceren en daardoor ook minder alcohol. Een van de manieren waarop dit gedaan wordt, is door zout toe te voegen aan het groeimedium van de gisten waardoor er osmotische stress ontstaat. Dit betekent dat de gisten door de hogere zoutconcentratie in het medium harder moeten werken om het zout buiten de cel te houden. Glycerol helpt de gistcel om het zout buiten te houden, en is daarom een natuurlijk middel om de osmotische stress te verlagen. Gisten met een hoge glycerolproductie zijn daarom beter bestand tegen osmotische stress en beter in staat om te overleven in een zout groeimedium. Door deze gisten honderden (!) generaties lang te laten groeien onder steeds zoutere en dus stressvollere omstandigheden wordt een evolutionaire druk uitgeoefend op de gisten. Van elke generatie gisten overleven enkel de gisten met de grootste weerbaarheid tegen deze osmotische stress, en dus de gisten met een aangepast koolstofmetabolisme dat meer glycerol produceert. Het is op deze manier gelukt om gisten te ontwikkelen die 41% meer glycerol produceren en zorgen voor een verlaging van het alcoholpercentage met 1.3% 9,14.

Saccharomyces cerevisiae gistcellen onder de elektronenmicroscoop
Aangepast van Mogana Das Murtey & Patchamuthu Ramasamy via CC BY-SA 3.0
Bovenstaande methode duurt lang en is zeer bewerkelijk. Er zijn daarom mutagene technieken ontwikkeld die de evolutie van gistcellen versnellen. Het is met deze technieken mogelijk om binnen enkele gistgeneraties een geschikte gist met de gewenste eigenschappen te ontwikkelen. Gistpopulaties kunnen bijvoorbeeld behandeld worden met UV-straling, alkylerende of deaminerende middelen waardoor er kleine mutaties ontstaan in het dna van de gistcellen. Het dna van deze gisten is veranderd, maar ze worden – omdat een mutagene techniek niet zorgt voor een gerichte aanpassing van het dna – niet als genetisch gemodificeerde organismen gezien. De gisten uit de gistpopulatie krijgen door de behandeling allemaal andere mutaties in hun dna. Het is nu de kunst om uit deze gemuteerde gistpopulatie de gisten te zoeken die mutaties hebben gekregen waardoor ze minder alcohol produceren, maar bijvoorbeeld meer glycerol. Net als hierboven kan dit gedaan worden door het zoutgehalte in het groeimedium van de gisten te verhogen. Vervolgens kan uit de overlevende gistcellen een nieuwe giststam gekweekt worden waarbij de gehele gistpopulatie de alcoholverlagende mutatie bevat. Erbslöh Geisenheim AG bezit het patent (nummer WO 2016/128296 AI) om op deze manier gisten te ontwikkelen die een lagere hoeveelheid alcohol produceren. Momenteel heeft Erbslöh onder het merk Oenoferm een gist op de markt gebracht dat minder alcohol produceert (tot 1% minder) en meer glycerol. Er worden echter ook hele specifieke voorschriften bij gegeven voor de vinificatie, en er wordt gewaarschuwd dat er een verhoging van de hoeveelheid vluchtige zuren kan plaatsvinden15.
Het gebruik van ‘wilde’ gisten
Waarom al die moeite doen als er ook een heel arsenaal aan ‘wilde’ gisten is die van nature al minder alcohol produceren? Ze hebben in tegenstelling tot de Saccharomyces cerevisiae gisten een koolstofmetabolisme dat resulteert in minder alcoholproductie, maar daarentegen vaak wel een hogere productie van azijnzuur, aceetaldehyde en andere ongewenste bijproducten. Desalniettemin kunnen deze bijproducten bij lage concentraties de wijn meer complexiteit geven en dus van positieve invloed zijn. Het nadeel is echter dat deze ‘wilde’ gisten over het algemeen niet bestand zijn tegen alcoholpercentages boven de 5-7% 16 waardoor ze niet alle suikers in de most kunnen omzetten. Om toch laag-alcoholische wijn te maken met behulp van deze wilde gisten kunnen ze sequentieel of samen geïnoculeerd worden met een klassieke Saccharomyces wijngist die de fermentatie afmaakt16,17.
LEES NU OOK: Snellere gistrijping door sonificatie
Er zijn verschillende giststammen geïdentificeerd van onder andere de gistsoorten Saccharomyces uvarum, Saccharomyces kudriavzevii, Candida membranaefaciens, Hanseniaspora uvarum, Lachancea thermotolerans, Metschnikowia pulcherrima, Pichia kudriavzevii, Pichia kluyverii, Torulaspora delbrueckii, en Zygosaccharomyces bailii die zorgen voor een verminderde alcoholproductie6,16,18-21. In de meeste gevallen zorgden deze gisten voor een verlaging van het alcoholpercentage van de wijn met minder dan 1%. Enkel met de gisten M.pulcherrima en de P. kluyveri is het gelukt het alcoholpercentage te verlagen met meer dan 3% 21. In alle gevallen (tenminste wanneer er ook een sensorische analyse was uitgevoerd) was er een verhoging van ongewenste bijproducten waarneembaar die de wijn zuurder, bitterder of minder fruitig maakten of zorgden voor ongewenste aroma’s van azijn en oxidatie. Daarnaast zijn deze gisten vaak in het lab met behulp van een suikeroplossing getest en nog maar in een enkel geval op industriële schaal met echt druivensap. Tevens is het mogelijk dat door een schaalvergroting van het lab naar de grote wijntanks in de wijnkelder de gisten zich anders gaan gedragen. Er is dus nog veel onderzoek nodig naar gisten die op ook op industriële schaal in staat zijn om laag-alcoholische wijn te produceren en sensorisch geen nadelig effecten hebben.
De toekomst van laag-alcoholische wijn
De totstandkoming van gisten voor de productie van laag-alcoholische wijn is nog enorm in ontwikkeling. Nog geen van de gebruikte methoden hebben geleid tot een wijngist die zorgt voor de productie van een wijn met spectaculair lagere alcoholpercentages. In het beste geval is het mogelijk om het alcoholpercentage met een paar procent te verlagen, maar hiervoor moet altijd een prijs worden betaald. De huidige onderzoeken laten zien dat een (forse) verlaging van de hoeveelheid alcohol (ongeacht de gebruikte methode) een negatieve invloed heeft op de kwaliteit van de wijn.
De veelgebruikte Saccharomyces cerevisae wijngisten hebben als groot voordeel dat hun koolstofmetabolisme is gericht op een vrij zuivere omzetting van glucose naar alcohol. Aanpassingen in dit koolstofmetabolisme zorgen voor de vorming van bijproducten die een nadelige invloed hebben op de kwaliteit van de wijn. Het is dan ook zeer de vraag of het überhaupt mogelijk is om een (combinatie van) gist(en) te ontwikkelen waarmee een volledige alcoholische fermentatie uitgevoerd kan worden, het alcoholpercentage bijvoorbeeld onder de 5% blijft, en waarvan de sensorische invloeden op de wijn acceptabel zijn. Om een écht laag-alcoholische wijn te produceren moet er daarom – wat betreft de kwaliteit – voorlopig wat water bij de wijn worden gedaan.
Bekijk alle diensten van WijnWetenschap
Referenties
1. Novello V, de Palma L. Viticultural strategy to reduce alcohol levels in wine, International Symposium: Alcohol level reduction in wine – Oenoviti international Network, 2013;3-8
2. Malherbe DF, du Toit M, Cordero Otero RR, van Rensburg P, Pretorius IS. Expression of the Aspergillus niger glucose oxidase gene in Saccharomyces cerevisiae and its potential applications in wine production. Applied microbiology and biotechnology. 2003;61(5-6):502-11.
3. Niebel B, Leupold S, Heinemann, M. An upper limit on Gibbs energy dissipation governs cellular metabolism. Nature metabolism. 2019;1:125-132.
4. Tilloy V, Cadiere A, Ehsani M, Dequin S. Reducing alcohol levels in wines through rational and evolutionary engineering of Saccharomyces cerevisiae. International journal of food microbiology. 2015;213:49-58.
5. Goold HD, Kroukamp H, Williams TC, Paulsen IT, Varela C, Pretorius IS. Yeast’s balancing act between ethanol and glycerol production in low-alcohol wines. Microbial biotechnology. 2017;10(2):264-78.
6. Varela J, Varela C. Microbiological strategies to produce beer and wine with reduced ethanol concentration. Current opinion in biotechnology. 2019;56:88-96.
7. Romano P, Brandolini V, Ansaloni C, Menziani E. The production of 2,3-butanediol as a differentiating character in wine yeasts. World journal of microbiology and biotechnology. 1998;14(5)649-653
8. Byrne S, Howell G. Acetaldehyde: How to limit its formation during fermentation. Australian Grapegrower & Winemaker. 2017;Feb,68-69.
9. Ozturk B, Anli E. Different techniques for reducing alcohol levels in wine: A review. BIO Web of Conferences. 37th World Congress of Vine and Wine and 12th General Assembly of the OIV (Part 1). 2014(3):02012
10. Varela C, Kutyna DR, Solomon MR, Black CA, Borneman A, Henschke PA, et al. Evaluation of gene modification strategies for the development of low-alcohol-wine yeasts. Applied and environmental microbiology. 2012;78(17):6068-77.
11. Eglinton JM, Heinrich AJ, Pollnitz AP, Langridge P, Henschke PA, de Barros Lopes M. Decreasing acetic acid accumulation by a glycerol overproducing strain of Saccharomyces cerevisiae by deleting the ALD6 aldehyde dehydrogenase gene. Yeast (Chichester, England). 2002;19(4):295-301.
12. Cambon B, Monteil V, Remize F, Camarasa C, Dequin S. Effects of GPD1 overexpression in Saccharomyces cerevisiae commercial wine yeast strains lacking ALD6 genes. Applied and environmental microbiology. 2006;72(7):4688-94.
13. Ehsani M, Fernandez MR, Biosca JA, Julien A, Dequin S. Engineering of 2,3-butanediol dehydrogenase to reduce acetoin formation by glycerol-overproducing, low-alcohol Saccharomyces cerevisiae. Applied and environmental microbiology. 2009;75(10):3196-205.
14. Tilloy V, Ortiz-Julien A, Dequin S. Reduction of ethanol yield and improvement of glycerol formation by adaptive evolution of the wine yeast Saccharomyces cerevisiae under hyperosmotic conditions. Applied and environmental microbiology. 2014;80(8):2623-32.
15. https://erbsloeh.com/fileadmin/user_upload/pdf/Wine/technical_data_sheet/GB/oenoferm_la_hog_f3-technical_data_sheet-english-erbsloeh.pdf (Geraadpleegd op 11 augustus 2019).
16. Ciani M, Morales P, Comitini F, Tronchoni J, Canonico L, Curiel JA, et al. Non-conventional Yeast Species for Lowering Ethanol Content of Wines. Frontiers in microbiology. 2016;7:642.
17. Varela C, Dry PR, Kutyna DR, Francis IL, Henschke PA, Curtin CD, Chambers PJ. Strategies for reducing alcohol concentration in wine. Australian Journal of Grape and Wine Research 2015;21: 670–679.
18. Contreras A, Hidalgo C, Schmidt S, Henschke PA, Curtin C, Varela C. The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content. International journal of food microbiology. 2015;205:7-15.
19. Querol A, Perez-Torrado R, Alonso-Del-Real J, Minebois R, Stribny J, Oliveira BM, et al. New Trends in the Uses of Yeasts in Oenology. Advances in food and nutrition research. 2018;85:177-210.
20. Maturano YP, Mestre MV, Kuchen B, Toro ME, Mercado LA, Vazquez F, et al. Optimization of fermentation-relevant factors: A strategy to reduce ethanol in red wine by sequential culture of native yeasts. International journal of Food Microbiology. 2019;289:40-8.
21. Rocker J, Strub S, Ebert K, Grossmann M. Usage of different aerobic non-Saccharomyces yeasts and experimental conditions as a tool for reducing the potential ethanol content in wines. European food research and technology 2016;242:2051-2070.
Bijzonder interessant artikel, met leuke grafics! Doe zo verder!
Beste Dirk-Antoon, Dank je wel!